martes, 21 de noviembre de 2017
lunes, 20 de noviembre de 2017
LOS RESIDUOS
En zonas urbanas con actividades muy diversificadas se producen diferentes tipos de residuos como los domesticos, industriales, asimilables a urbanos, de construccion y objetos de gran tamaños( electrodomesticos, muebles...)
En cuanto al tratamiento se distinguen los siguientes:
Vertederos controlados: los residuos se depositan en celulas y se cubren con tierras formando capas. Una vez lleno el vertedero se cubre de tierra vegetal.

Incineración: consiste en quemar los residuos. Su principal problema es la formación de residuos gaseosos.
Producción de metano: La descomposición natural de la materia organica produce un gas, rico en metano y dioxido de carbono, que se utiliza en la red de gas ciudad o bien se quema para producir energía electrica.
Compostaje: la materia organica se titula con objeto de eliminar la mayor cantidad de agua posible. El resultado es una especie de humus que sirve de abono.
Reciclados de materiales: La decison de recuperar materiales regenerables esta en función de los gastos economicos que se pueden realizar. Actualmente existen metodos tecnologicos para separar papel, vidrio, hierro y otros materiales no ferricos.
El mayor problema de la recuperacion consiste en la separación de los materiales. Se puede realizar en origen (mediante contenedores especializados) o en plantas diseñadas para ello. La separacion presenta muchos problemas y es muy cara.
En cuanto al tratamiento se distinguen los siguientes:
Vertederos controlados: los residuos se depositan en celulas y se cubren con tierras formando capas. Una vez lleno el vertedero se cubre de tierra vegetal.

Incineración: consiste en quemar los residuos. Su principal problema es la formación de residuos gaseosos.
Producción de metano: La descomposición natural de la materia organica produce un gas, rico en metano y dioxido de carbono, que se utiliza en la red de gas ciudad o bien se quema para producir energía electrica.
Compostaje: la materia organica se titula con objeto de eliminar la mayor cantidad de agua posible. El resultado es una especie de humus que sirve de abono.
Reciclados de materiales: La decison de recuperar materiales regenerables esta en función de los gastos economicos que se pueden realizar. Actualmente existen metodos tecnologicos para separar papel, vidrio, hierro y otros materiales no ferricos.
El mayor problema de la recuperacion consiste en la separación de los materiales. Se puede realizar en origen (mediante contenedores especializados) o en plantas diseñadas para ello. La separacion presenta muchos problemas y es muy cara.
EL TITANIO Y SUS ALEACIONES
Son materiales de utilizacion muy reciente, que presentan una serie de propiedades de muy buena combinación. El titanio puro tiene una densidad baja y un punto de fusión muy elevado. Estas aleaciones poseen una extremada resistencia, son muy dúctiles y facilmente forjables.
El principal inconveniente del titanio es su alto poder de reacción con otros materiales a altas temperaturas. Debido a esta limitación se hace necesario el diseño de tecnicas de moldeo y afines para obtener este tipo de aleaciones. A pesar de todo, la resistencia a la corrosión es muy elevada, y tienen un buen comportamiento frente a ambientes marinos, atmosfericos, y muchos productos industriales.
El principal inconveniente del titanio es su alto poder de reacción con otros materiales a altas temperaturas. Debido a esta limitación se hace necesario el diseño de tecnicas de moldeo y afines para obtener este tipo de aleaciones. A pesar de todo, la resistencia a la corrosión es muy elevada, y tienen un buen comportamiento frente a ambientes marinos, atmosfericos, y muchos productos industriales.
jueves, 16 de noviembre de 2017
EL MAGNESIO Y SUS ALEACIONES
La característica más relevante es su densidad, por tanto se utilizan por su bajo peso. El magnesio tiene una estructura cristalina HC, relativamente blanda. A temperatura ambiente el magnesio y sus aleaciones se deforman con dificultad debido a la estructura cristalina. Quimicamente, las aleaciones de magnesio son inestables y susceptibles a la corrosión marina. pero son relativamente resistentes a la corrosión atmosférica.El magnesio además de tener como desventaja frente al aluminio el precio, presenta el inconveniente de que en estado líquido arde en contacto con el aire.
Las aleaciones de magnesio se clasifican en moldeables y forjables, algunas se pueden tratar térmicamente. Los elementos más comunes son aluminio, cinc y manganeso.


EL ALUMINIO Y SUS ALEACIONES
Tanto el aluminio como sus aleaciones se caracterizan por la relativa baja densidad, las elevadas conductividades eléctricas y térmicas, y la resistencia a la corrosión. Por su elevada ductilidad, se puede trabajar con facilidad hasta convertirlo en papel. Su principal limitación es la baja temperatura de fusión.
El aumento de la resistencia mecánica del aluminio se consigue por acrietud y por aleación. No obstante, ambos procesos disminuyen su resistencia a la corrosión. Los elementos mas comunes en la aleación de aluminio son cobre, magneso, sicilio y cinc. Las aleaciones se suelen clasificar en aleaciones para moldeo y aleaciones para forja.

El aumento de la resistencia mecánica del aluminio se consigue por acrietud y por aleación. No obstante, ambos procesos disminuyen su resistencia a la corrosión. Los elementos mas comunes en la aleación de aluminio son cobre, magneso, sicilio y cinc. Las aleaciones se suelen clasificar en aleaciones para moldeo y aleaciones para forja.

jueves, 9 de noviembre de 2017
EL COBRE Y SUS ALEACIONES
El cobre sin alear es tan blando y ductil que es dificil de mecanizar, pero tiene una buena capacidad para ser trabajado en frio. Resiste muy bien a la corrosión. La resistencia mecanica y el comportamiento ante la corrosión del cobre mejoran con su aleación. La mayoría de las aleaciones no se endurezen con tratamientos térmicos, pero esta propiedad se mejora mediante acritud y formacion de disoluciones sólidas.
La aleación más común del cobre es el latón, donde el cinc se considera el soluto y principal componenten de la aleación. Los bronces son aleaciones de cobre con estaño, que también puede contener aluminio, sicilio y níquel; son más resistentes que los latones y tienen gran resistencia a la corrosión. Se emplean cuando se requiere una elevada resistencia a la corrosión y buena resistencia a la tracción, así como a desgaste, por lo que son muy apreciados para cojinetes y engranajes.
Riopar Viejo y la Fabrica de Bronce
La Reales fábricas de bronce y latón de San Juan de Riópar (Albacete) fueron creadas en 1773 por el ingeniero vienés nacionalizado español Juan Jorge Graubner, atraído por la noticia de la existencia de una mina de calamina, mineral del que se extrae cinc para fundirlo con cobre y crear la aleación llamada latón, y su actividad industrial se prolongó durante 156 años.
Al estar encaramado sobre una roca, lo que le da unas vistas impresionantes, no pudo seguir expandiéndose. Por esto, y coincidiendo con la fundación de la Real Fábrica de Bronce de San Juan de Alcaraz en el siglo XVIII, se creó el pueblo de Riópar a unos 6 kilómetros.
La Real Fábrica de Bronce, que data del siglo XVIII y que fue la primera de España y segunda del mundo. La ubicación de una fábrica de este tipo en esta zona era perfecta por varios motivos. Aquí había minas de calamina, de donde se extrae el zinc. Y además hay agua y madera, dos elementos fundamentales para poner en funcionamiento las fábricas. En total había 8 y cada una se encargaba de una parte del proceso de fabricación del bronce. En ellas se elaboraba latón (aleación de cobre + zinc) y bronce (cobre + estaño). El cobre se traía de fuera.

A pesar de que nunca fue rentable económicamente, siempre estuvo abierta. Incluso durante la Guerra Civil, aunque les obligasen a fabricar bombas. A lo largo de los años, Riópar ha tenido varios nombres: Reales Fábricas de San Juan de Alcaraz, Fábricas de San Juan de Alcaraz, Fábricas de Riópar y, finalmente, Riópar. Por ello, es bastante común que la gente siga refiriéndose a este pueblo como Fábricas. Toda esta evolución nominal tiene sentido, ya que Riópar existe gracias a esta industria.

ALEACIONES NO FÉRRICAS
Los productos siderúrgicos tienen como principales defectos:
- una densidad relativamente elevada.
- conductividad eléctrica comparativamente baja.
- sensibles a la corrosión y oxidacion atmosférica.
Altos hornos en España
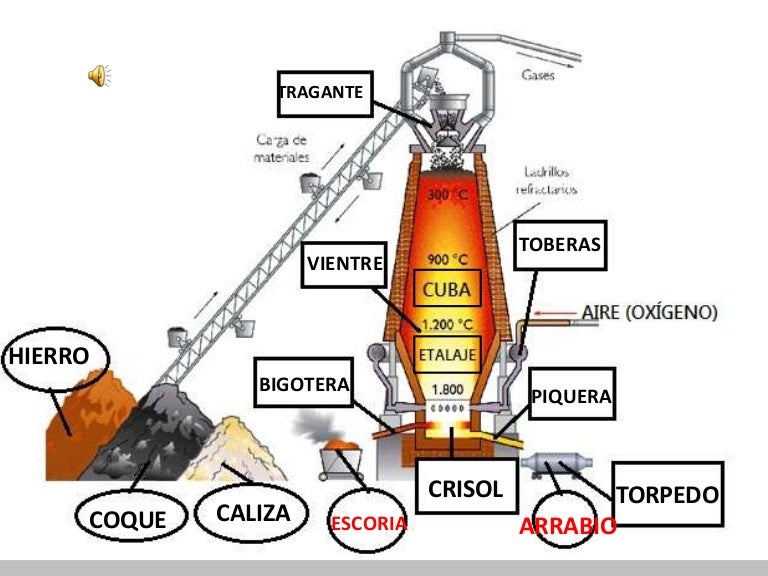 Con el título "Atlas de la industrialización en España, 1750-2000” la Fundación BBVA ha publicado un extenso y documentado trabajo, bajo la dirección del profesor Jordi Nadal, sobre la economía industrial en nuestro país. Pese a que el producto industrial se ha multiplicado por 110 ó 120 en el curso de los 150 últimos años, la economía ha sido menos dinámica que en países como el Reino Unido, Francia, Alemania o Italia, que por su extensión pueden compararse con España.
Con el título "Atlas de la industrialización en España, 1750-2000” la Fundación BBVA ha publicado un extenso y documentado trabajo, bajo la dirección del profesor Jordi Nadal, sobre la economía industrial en nuestro país. Pese a que el producto industrial se ha multiplicado por 110 ó 120 en el curso de los 150 últimos años, la economía ha sido menos dinámica que en países como el Reino Unido, Francia, Alemania o Italia, que por su extensión pueden compararse con España.
"El PIB industrial español ha ido ganando posiciones con respecto al de los países avanzados de Europa (salvo en 1950, una fecha inserta dentro de la posguerra civil), sin llegar a alcanzarlo nunca (inferior al 30% en 1950, cercano al 80% en 1996)". Este ascenso, más rápido que el de los países industrializados de Europa, debido a la extrema debilidad del punto de partida, "expresa al mismo tiempo el mérito y la insuficiencia del progreso industrial” de España.
La industria siderúrgica española ha experimentado poco más o menos, las mismas vicisitudes. Atraso técnico, combustible caro o de mala calidad y un mercado de dimensiones reducidas hicieron que la siderurgia española, a lo largo del siglo XIX, no pudiera competir con productos ingleses, belgas o alemanes.
La industria siderúrgica española ha experimentado poco más o menos, las mismas vicisitudes. Atraso técnico, combustible caro o de mala calidad y un mercado de dimensiones reducidas hicieron que la siderurgia española, a lo largo del siglo XIX, no pudiera competir con productos ingleses, belgas o alemanes.
 Los primeros altos hornos privados surgieron en Lugo (Galicia). Concretamente en 1794 y en Sargadelos. Con anterioridad, la Monarquía, para sus necesidades de armamento, había instalado algunos altos hornos.
Los primeros altos hornos privados surgieron en Lugo (Galicia). Concretamente en 1794 y en Sargadelos. Con anterioridad, la Monarquía, para sus necesidades de armamento, había instalado algunos altos hornos.
Más tarde, la siderurgia pasó a Andalucía. Siguiendo el modelo europeo de altos hornos al carbón vegetal y afinación y laminación a la hulla se instalaron plantas en Marbella (Málaga) y en Cazalla de la Sierra (Sevilla).
Pero la hegemonía de la siderurgia andaluza no pudo prolongarse más allá de 1863, “Cuando las fábricas asturianas de Mieres (desde 1852) y La Felguera (desde 1.859) empezaron a trabajar a pleno rendimiento.
La primacía de Asturias se debió a la abundancia de hulla y de mena de hierro en su territorio. Pero esta primacía, después de la irrupción del convertidor Bessermer, pasó a Vizcaya. Al terminar en 1876 la Segunda Guerra Carlista, algunos empresarios europeos con el fin de conseguir mineral barato para sus altos hornos, comenzaron a instalarse en la ría del Nervión. La oferta aparecía así dividida entre los productores asturianos y vascos. Empezó una gradual sustitución de los convertidores Bessemer por otros sistemas de fabricación, difundidos en Europa y EEUU. Apareció así el "horno abierto" Martin-Siemens que mejoraba el método del Bessemer.
Se acentuó la hegemonía vizcaína al frente de la siderurgia española y se concentró toda la producción en el norte. En la época de la Gran Guerra, el primer productor siderúrgico de España era Vizcaya, seguida de Asturias y después Santander, Alava, Guipúzcoa y Navarra.
Se acentuó la hegemonía vizcaína al frente de la siderurgia española y se concentró toda la producción en el norte. En la época de la Gran Guerra, el primer productor siderúrgico de España era Vizcaya, seguida de Asturias y después Santander, Alava, Guipúzcoa y Navarra.
 Las fábricas andaluzas habían dejado de producir. Y Altos Hornos de Vizcaya empresa creada en 1902, a partir de la fusión de otras dos sociedades, se convirtió en la dominante en la siderurgia española.
Las fábricas andaluzas habían dejado de producir. Y Altos Hornos de Vizcaya empresa creada en 1902, a partir de la fusión de otras dos sociedades, se convirtió en la dominante en la siderurgia española.
Después de la Primera Guerra Mundial, a las provincias cantábricas se añadieron dos nuevas competidoras, Barcelona y sobre todo Valencia, que en los años 20 superó a Asturias.
Después con el franquismo, se creó Ensidesa, que dio lugar a Aceralia, que se integró con la francesa Usinor y la luxemburguesa Arbed, creando así la actual Arcelor.
Después con el franquismo, se creó Ensidesa, que dio lugar a Aceralia, que se integró con la francesa Usinor y la luxemburguesa Arbed, creando así la actual Arcelor.
lunes, 6 de noviembre de 2017
Diagrama Hierro-Carbono
En el diagrama de equilibrio o diagrama de fases hierro-carbono (Fe-C) (también diagrama hierro-carbono), se representan las transformaciones que sufren los aceros al carbono con la temperatura, admitiendo que el calentamiento (o enfriamiento) de la mezcla se realiza muy lentamente, de modo tal que los procesos de difusión (homogeneización) tengan tiempo para completarse. Dicho diagrama se obtiene experimentalmente identificando los puntos críticos, temperaturas a las que se producen las sucesivas transformaciones por diversos métodos.

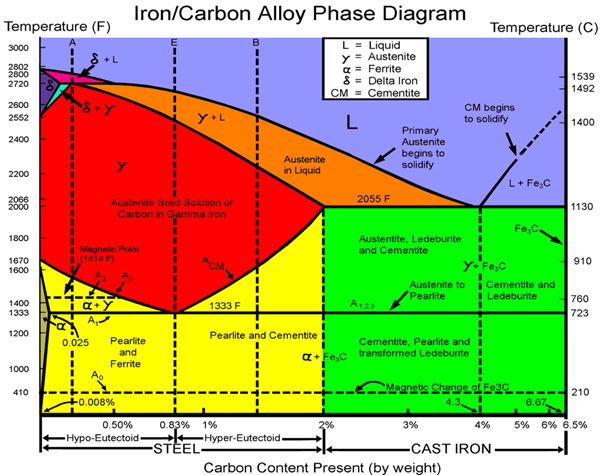

Zona de los aceros (hasta un 2 % de carbono) del diagrama de equilibrio metaestable hierro-carbono. Dado que, en los aceros, el carbono se encuentra formando carburo de hierro, se han incluido, en abscisas, las escalas de los porcentajes en peso de carbono y de carburo de hierro (en azul).
En la siguiente imagen podemos ver el mismo diagrama, con un mayor contraste para facilitar su comprension:

Y este diagrama es el que estudiamos en 1º de bachiller:


martes, 31 de octubre de 2017
Josiah Willard Gibbs
Josiah Willard Gibbs (New Haven, Connecticut, Estados Unidos, 11 de febrero de 1839–íd., 28 de abril de 1903) fue un físico estadounidense que contribuyó de forma destacada a la fundación teórica de la termodinámica.
Datos biográficos
Estudió en la Universidad de Yale, donde recibió el primer doctorado en Filosofía otorgado en ingeniería en los Estados Unidos por su tesis titulada "Sobre la forma de los dientes de las ruedas en los engranajes (On the Form of the Teeth of Wheels in Spur Gearing)" en la cual utilizaba métodos geométricos para investigar la optimización del diseño de los engranajes.
En 1886 fue a vivir a Europa, donde permaneció tres años: París, Berlín y Heidelberg. En 1871 fue nombrado profesor de física matemática en la Universidad de Yale. Enfocó su trabajo al estudio de la Termodinámica; y profundizó asimismo la teoría del cálculo vectorial, donde paralelamente a Heaviside opera separando la parte real y la parte vectorial del producto de dos cuaternios puros, con la idea de su empleo en física; en la actualidad es en ambos campos considerado un pionero.
Eponimia
El cráter lunar Gibbs lleva este nombre en su memoria.
En 1886 fue a vivir a Europa, donde permaneció tres años: París, Berlín y Heidelberg. En 1871 fue nombrado profesor de física matemática en la Universidad de Yale. Enfocó su trabajo al estudio de la Termodinámica; y profundizó asimismo la teoría del cálculo vectorial, donde paralelamente a Heaviside opera separando la parte real y la parte vectorial del producto de dos cuaternios puros, con la idea de su empleo en física; en la actualidad es en ambos campos considerado un pionero.
Eponimia
El cráter lunar Gibbs lleva este nombre en su memoria.
martes, 26 de septiembre de 2017
Características y aplicaciones de la fibra de kevlar
 El Kevlar® o poliparafenileno tereftalamida es una poliamida sintetizada por primera vez en 1965 por la química polaco-estadounidense Stephanie Kwolek (1923-2014), quien trabajaba para DuPont. La obtención de las fibras de Kevlar fue complicada, destacando el aporte de Herbert Blades, que solucionó el problema de qué disolvente emplear para el procesado. Finalmente, DuPont empezó a comercializarlo en 1972. Es muy resistente y su mecanización resulta muy difícil. A finales de los años setenta, la empresa AkzoNobel desarrolló una fibra con estructura química similar que posteriormente comercializó con el nombre de Twaron.
El Kevlar® o poliparafenileno tereftalamida es una poliamida sintetizada por primera vez en 1965 por la química polaco-estadounidense Stephanie Kwolek (1923-2014), quien trabajaba para DuPont. La obtención de las fibras de Kevlar fue complicada, destacando el aporte de Herbert Blades, que solucionó el problema de qué disolvente emplear para el procesado. Finalmente, DuPont empezó a comercializarlo en 1972. Es muy resistente y su mecanización resulta muy difícil. A finales de los años setenta, la empresa AkzoNobel desarrolló una fibra con estructura química similar que posteriormente comercializó con el nombre de Twaron.
La ligereza y la excepcional resistencia a la rotura de estas poliaramidas hacen que sean empleadas en neumáticos, velas náuticas y en chalecos antibalas.
Tipos de fibras de kevlar
El kevlar 29 es la fibra tal y como se obtiene de su fabricación. Se usa típicamente como refuerzo en tiras por sus buenas propiedades mecánicas, o para tejidos. Entre sus aplicaciones está la fabricación de cables, ropa resistente (de protección) o chalecos antibalas.
El kevlar 49 se emplea cuando las fibras se van a embeber en una resina para formar un material compuesto. Las fibras de kevlar 49 están tratadas superficialmente para favorecer la unión con la resina. El kevlar 49 se emplea como equipamiento para deportes extremos, para altavoces y para la industria aeronáutica, aviones y satélites de comunicaciones y cascos para motos.
Propiedades mecánicas
Rigidez
El kevlar posee una excepcional rigidez para tratarse de una fibra polimérica.
Resistencia
El kevlar posee una excepcional resistencia a la tracción, de en torno a los 3,5 GPa.6. La excepcional resistencia del kevlar se debe a la orientación de sus cadenas moleculares, en dirección del eje de la fibra, así como a la gran cantidad de enlaces por puentes de hidrógeno entre las cadenas.
Elongación a rotura
El kevlar posee una elongación a rotura de en torno al 3,6 % (kevlar 29) y 2,4 % (kevlar 49). Esto hace que el kevlar sea un material más tenaz y absorba mucha mayor cantidad de energía que el acero antes de su rotura.
Tenacidad
La tenacidad (energía absorbida antes de la rotura) del Kevlar está en torno a los 50 MJ m-3, frente a los 6 MJ m-3 del acero.
Propiedades térmicas
El kevlar se descompone a altas temperaturas (entre 420 y 480 grados Celsius), manteniendo parte de sus propiedades mecánicas incluso a temperaturas cercanas a su temperatura de descomposición.
El módulo elástico se reduce en torno a un 20 % cuando se emplea la fibra a 180 grados Celsius durante 500 h.6 Esta propiedad, junto con su resistencia química, hacen del kevlar un material muy utilizado en equipos de protección.
Usos del kevlar
- Cables de carga [USB] para dispositivos móviles
- Chaquetas, e impermeables.
- Tenis
- Cuerdas y bolsas de aire en el sistema de aterrizaje de la nave Mars Pathfinder.
- Cuerdas de pequeño diámetro.
- Hilo para coser.
- Petos y protecciones para caballos de picar toros.
- Blindaje antimetralla en los motores jet de avión y de protección a los pasajeros en caso de explosión.
- Neumáticos que funcionan desinflados.

viernes, 22 de septiembre de 2017
REDES CRISTALOGRAFICAS DE BRAVAIS
SISTEMAS CRISTALINOS Y REDES DE BRAVAIS
Un sólido cristalino se construye a partir de la repetición en el espacio de una estructura elemental paralelepipédica denominada celda unitaria. En función de los parámetros de red, es decir, de las longitudes de los lados o ejes del paralelepípedo elemental y de los ángulos que forman, se distinguen siete sistemas cristalinos y se dividen en: cúbico, hexagonal, tetragonal, trigonal, rómbico, monoclínico y triclínico.
Una red de Bravais (físico francés A. Bravais ) es un arreglo infinito de puntos discretos con un ordenamiento y orientación, que parece exactamente la misma, desde cualquier punto de observación. En 1848 el físico e mineralogista francés Auguste Bravais (1811-1863) descubrió que sólo hay 14 redes únicas en los sistemas cristalinos tridimensionales.| Estructura | a (r) | Número de coordinación | Factor de empaquetamiento | Ejemplos |
|---|---|---|---|---|
| Cúbica simple (CS) | a = 2r | Po | ||
| Cúbica centrada en el cuerpo (BCC) | a = 4r/√3 | Fe, W, Mo, Nb, Ta, K, Na, V, Cr, Zr | ||
| Cúbica centrada en las caras (FCC) | a = 4r/√2 | Cu, Al, Au, Ag, Pb, Ni, Pt | ||
| Hexagonal compacta (HCP) | a = 2r c/a = 1,633 | Ti, Mg, Zn, Be, Co, Zr, Cd |
Proceso de cristalización.
En los metales y aleaciones líquidas, calentados considerablemente por encima de su punto de fusión, los átomos se agrupan a azar, de modo irregular y son portadores de elevada energía y movimiento. A medida que el líquido se enfría y se acerca al punto de solidificación, la energía de algunos átomos puede haber disminuido y con ello su movilidad dentro de la masa, de tal forma que pueden ocupar, respecto a los otros, una posición más orientada, lo que se asemeja a su disposición en el metal sólido.Una vez alcanzada la temperatura de solidificación, estos grupos aislados de átomos pueden haber quedado ya orientados y enlazados como el cristal elemental, adquiriendo una estructura rígida de orientación los unos respecto a los otros. Los átomos vecinos pueden, una vez perdida la energía térmica necesaria, irse agregando al cristal elemental formado, formando nuevos cristales elementales unidos y comenzar dentro de la masa líquida a formar redes cristalinas en crecimiento. Estos cristales en crecimiento, cuando alcanzan cierto tamaño se convierten en núcleos de cristalización, y a su alrededor comienza a tejerse la red cristalina, a medida que más y más átomos van perdiendo energía con el enfriamiento.
Como la formación de los núcleos de cristalización puede comenzar indistintamente en cualquier parte de la masa líquida, los cristales pueden comenzar a crecer en múltiples lugares simultáneamente.
En el proceso de cristalización, mientras que el líquido circunde al cristal ya formado y creciente, este va manteniendo una forma relativamente correcta, los átomos vecinos se van enlazando en la posición adecuada y la red cristalina se incrementa manteniendo su geometría. Sin embargo, debido a que la transferencia de calor del material fundido puede ser diferente en diferentes direcciones; por ejemplo, mayor hacia las paredes de molde o recipiente, la red cristalina pueden ir creciendo en unas direcciónes mas que en otras por lo que los cristales van adquiriendo una forma alargada y se constituyen en los llamados ejes de cristalización.
A partir de los primeros ejes, en direcciones perpendiculares tiene lugar el crecimiento de nuevos ejes. A partir de estos nuevos ejes, también en direcciones perpendiculares, crecen otros ejes, que por su parte dan lugar a otros etc. Las ramas formadas van creciendo en dirección de su engrosamiento y multiplicación progresivos, lo que conduce a la interpenetración y formación del cuerpo sólido.
Suscribirse a:
Entradas (Atom)
Memoria proyecto
Memoria proyecto tecnologia de Juan Torrijos Torres
-
El funcionamiento del tren bala se basa en la leviacion magnetica mediante la utilizacion de superconductores. Hay dos tipos de supercondu...
-
El Efecto Meissner- Ochsenfeld fue descubierto por Walther Meissner y Robert Ochsenfeld en 1933, y consiste en que cuando un superconduct...





